近日,中國(guó)農(nóng)業(yè)科學(xué)院北京畜牧獸醫(yī)研究所基因工程與種質(zhì)創(chuàng)新科技創(chuàng)新團(tuán)隊(duì)揭示了銅轉(zhuǎn)運(yùn)蛋白ATP7A在調(diào)控動(dòng)物脂肪代謝中的重要作用,發(fā)現(xiàn)了銅過(guò)載通過(guò)增強(qiáng)DNA損傷反應(yīng)和脂肪水解加速脂肪萎縮的機(jī)制。這一研究為人類(lèi)脂肪細(xì)胞衰老、2型糖尿病和代謝綜合征的發(fā)病機(jī)制的理解和疾病預(yù)防提供了新的視角,為畜禽生產(chǎn)中銅的科學(xué)合理利用提供了理論參考。相關(guān)研究成果在線發(fā)表在《糖尿病學(xué)(Diabetologia)》上。
脂肪組織是動(dòng)物的主要儲(chǔ)能和內(nèi)分泌器官,不僅關(guān)系著畜禽的生產(chǎn)效率和肉品質(zhì),而且與人類(lèi)肥胖和代謝性疾病密切相關(guān)。隨著人類(lèi)飲食結(jié)構(gòu)和生活方式的改變,研究發(fā)現(xiàn)西方飲食中較低的銅水平與肥胖、糖尿病等代謝疾病的發(fā)生有關(guān),但是補(bǔ)銅是否有助于肥胖和代謝紊亂的改善仍不清楚。在畜牧業(yè)生產(chǎn)中,飼料中添加高劑量銅能促進(jìn)動(dòng)物生長(zhǎng),提高飼料報(bào)酬。但是高銅對(duì)動(dòng)物脂肪代謝的影響及其分子機(jī)理尚不明確。
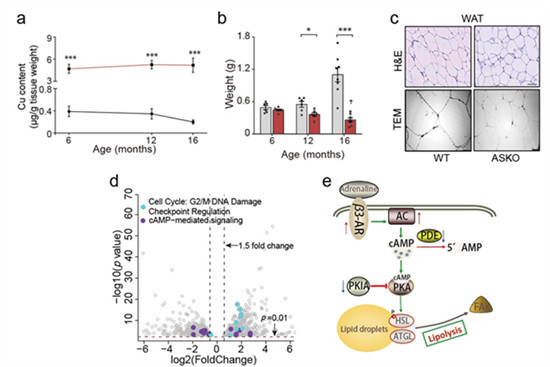
銅是一種生物體必需的金屬微量元素,通過(guò)調(diào)節(jié)細(xì)胞氧化還原平衡、能量產(chǎn)生、鐵穩(wěn)態(tài)等過(guò)程參與機(jī)體一系列生命活動(dòng)中。由于維持細(xì)胞內(nèi)銅水平的相對(duì)穩(wěn)定,受到銅轉(zhuǎn)運(yùn)蛋白的精細(xì)調(diào)控,而ATP7A在細(xì)胞銅輸出過(guò)程起著關(guān)鍵調(diào)控作用,可以保護(hù)細(xì)胞銅的過(guò)度積累,該研究通過(guò)構(gòu)建銅離子轉(zhuǎn)運(yùn)蛋白ATP7A脂肪特異性敲除小鼠,使得該小鼠脂肪組織銅水平比對(duì)照組高20倍。研究發(fā)現(xiàn),基因敲除小鼠6月齡前生長(zhǎng)代謝未受脂肪組織銅過(guò)載的影響,而達(dá)到12月齡時(shí),敲除小鼠脂肪沉積顯著減少,并在16月齡時(shí)進(jìn)一步減少,伴隨著內(nèi)分泌紊亂和胰島素抵抗等代謝障礙,脂肪組織老化信號(hào)增強(qiáng)。同時(shí),基因敲除小鼠在60%高脂飼料飼喂條件下,7月齡時(shí)即出現(xiàn)上述代謝障礙,說(shuō)明高脂飲食可以加速敲除小鼠年齡誘導(dǎo)的代謝衰退。機(jī)制研究發(fā)現(xiàn),脂肪組織銅過(guò)載加劇了高脂飲食和年齡誘導(dǎo)的DNA損傷,增強(qiáng)了cAMP脂肪水解信號(hào),加速了脂肪細(xì)胞衰老和萎縮;并且,體外高銅培養(yǎng)的脂肪細(xì)胞表現(xiàn)出DNA損傷信號(hào)的激活和脂肪水解的增強(qiáng)。綜上所述,該研究發(fā)現(xiàn)脂肪細(xì)胞銅過(guò)載通過(guò)激活DNA損傷和脂解信號(hào),引起年齡和高脂飲食誘導(dǎo)的脂肪萎縮,從而導(dǎo)致胰島素抵抗和糖脂代謝紊亂發(fā)生。該研究從脂肪細(xì)胞老化的角度,闡明了銅對(duì)機(jī)體糖脂代謝的調(diào)控作用及機(jī)制。
該研究得到科技部973計(jì)劃、國(guó)家自然科學(xué)基金和中國(guó)農(nóng)科院科技創(chuàng)新工程等項(xiàng)目資助。(通訊員 高冰清)
原文鏈接: https://link.springer.com/content/pdf/10.1007%2Fs00125-019-4966-2.pdf